在生物醫(yī)藥領(lǐng)域,“精準(zhǔn)遞送" 一直是攻克疾病的核心難題 —— 如何讓藥物避開(kāi)生理屏障、直達(dá)病灶并精準(zhǔn)釋放,是科研人員不懈探索的方向。近日,《ACS Omega》期刊發(fā)表的一項(xiàng)研究給出了新答案:基于 β- 環(huán)糊精的交聯(lián)納米顆粒(CD-CO NPs),憑借優(yōu)異的生物相容性、pH 響應(yīng)降解性和高載藥能力,成為很有潛力的新型藥物遞送載體。而這一成果的落地,離不開(kāi)納米粒度分析(DLS) 與zeta 電位分析技術(shù)的全程支撐。
理想的納米藥物載體,需要同時(shí)滿(mǎn)足 “穩(wěn)定循環(huán)"“高效靶向"“安全降解" 三大要求,而這兩點(diǎn)特性直接決定其性能:
• 粒徑大小:若粒徑過(guò)大(>400nm),易被人體免疫系統(tǒng)清除,無(wú)法穿透腫瘤組織間隙;若過(guò)小(<50nm),則可能提前滲透到非靶組織,增加毒副作用。
• 表面電荷:合適的表面電荷能避免載體團(tuán)聚(如負(fù)電荷可減少與帶負(fù)電細(xì)胞膜的非特異性吸附),同時(shí)影響細(xì)胞攝取效率 —— 這正是 zeta 電位的核心檢測(cè)價(jià)值。
此次研究中,科研團(tuán)隊(duì)通過(guò)納米粒度與 zeta 電位測(cè)試,將 CD-CO NPs 的性能 “精準(zhǔn)調(diào)控" 到理想范圍,最終實(shí)現(xiàn)藥物的高效遞送。
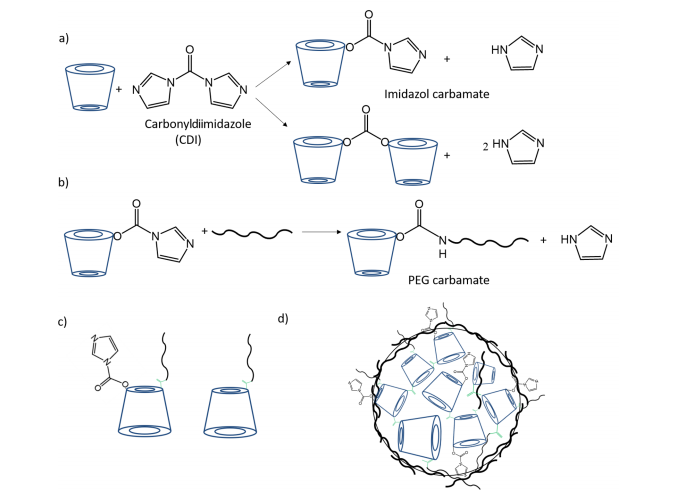
圖1.(a)β-環(huán)糊精(CD)游離羥基的環(huán)糊精偶聯(lián)反應(yīng)(CDI)及(b)咪唑氨基甲酸酯中間體與甲氧基聚乙二醇胺的反應(yīng)示意圖。圖(c)展示了β-環(huán)糊精與氨基-PEG可能發(fā)生反應(yīng)的示意圖,(d)為最終形成的環(huán)糊精-氨基甲酸酯納米顆粒(CD-CO NPs)結(jié)構(gòu)。
傳統(tǒng)環(huán)糊精納米載體的制備,常面臨 “粒徑不均"“需機(jī)械破碎" 的問(wèn)題(如部分納米海綿粒徑>400nm),導(dǎo)致其難以滿(mǎn)足體內(nèi)遞送需求。而本研究通過(guò)動(dòng)態(tài)光散射(DLS) 技術(shù),實(shí)現(xiàn)了從 “試錯(cuò)合成" 到 “精準(zhǔn)調(diào)控" 的突破:
科研團(tuán)隊(duì)以 β- 環(huán)糊精(β-CD)和碳二亞胺(CDI)為原料,測(cè)試了 1:6~1:18 的不同原料配比。通過(guò) DLS 實(shí)時(shí)檢測(cè) aqueous suspension 中納米顆粒的 hydrodynamic diameter(水合粒徑),發(fā)現(xiàn)當(dāng) β-CD:CDI=1:12 時(shí),顆粒粒徑分布最窄(PDI 低至 0.255),水合粒徑穩(wěn)定在 200-300nm—— 這一尺寸既能避免被腎臟過(guò)快濾過(guò),又能穿透腫瘤組織的 “增強(qiáng)滲透滯留效應(yīng)(EPR)",為后續(xù)藥物遞送奠定基礎(chǔ)。

圖2:未聚乙二醇化環(huán)糊精-環(huán)糊精內(nèi)酯(CD-CO)納米顆粒在水中的動(dòng)態(tài)光散射(DLS)測(cè)量結(jié)果(左圖):不同環(huán)糊精摩爾比的樣品:1:6(藍(lán)色)、1:12(紅色)和1:18(黑色)。
納米載體的 “長(zhǎng)期穩(wěn)定性" 是其產(chǎn)業(yè)化的關(guān)鍵 —— 若在儲(chǔ)存或體內(nèi)循環(huán)中發(fā)生團(tuán)聚,將直接失效。研究團(tuán)隊(duì)通過(guò) DLS 對(duì) CD-CO NPs 進(jìn)行了長(zhǎng)達(dá) 1 個(gè)月的追蹤:在中性水溶液(pH=7)中,顆粒水合粒徑始終維持在 200-300nm,無(wú)明顯變化;即便在細(xì)胞培養(yǎng)基(DMEM)或緩沖液(PBS)中,仍保持良好分散性。這一結(jié)果通過(guò) DLS 的 “強(qiáng)度 / 數(shù)量加權(quán)分布" 雙重驗(yàn)證,為其后續(xù)體內(nèi)應(yīng)用提供了可靠數(shù)據(jù)支撐。
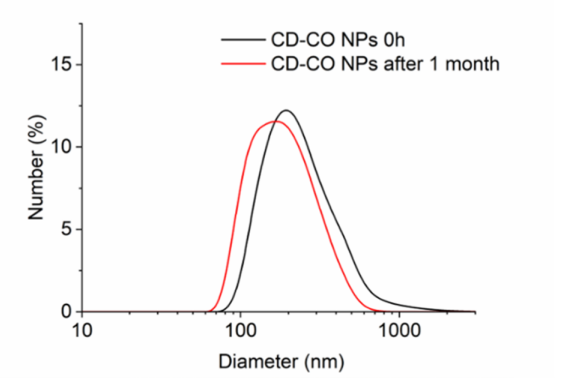
圖3.粒徑介于100-160納米之間的CD-CO納米顆粒的DLS測(cè)量顯示(流體動(dòng)力學(xué))粒徑分布峰值在200-300納米,且在水中可保持?jǐn)?shù)月的膠體穩(wěn)定性
納米顆粒的團(tuán)聚問(wèn)題,是制約其應(yīng)用的 “老大難"—— 傳統(tǒng)未修飾的環(huán)糊精納米顆粒,在水溶液中幾分鐘內(nèi)就會(huì)絮凝。而本研究通過(guò)zeta 電位分析,找到了解決方案:
研究團(tuán)隊(duì)通過(guò) zeta 電位檢測(cè)發(fā)現(xiàn),PEG 修飾后的 CD-CO NPs 在 pH=7.3 時(shí),表面電荷為 - 14mV。這一弱負(fù)電位源于 β- 環(huán)糊精分子暴露的羥基 —— 負(fù)電荷間的排斥作用,有效抑制了顆粒間的團(tuán)聚,使其在水溶液中穩(wěn)定分散數(shù)周。反觀未 PEG 修飾的顆粒,因表面電荷雜亂,zeta 電位無(wú)穩(wěn)定峰值,最終快速絮凝。
zeta 電位不僅影響膠體穩(wěn)定性,還與載體的 “體內(nèi)清除" 密切相關(guān):過(guò)度負(fù)電或正電的顆粒,易被血液中的蛋白吸附(形成 “蛋白冠"),進(jìn)而被巨噬細(xì)胞清除;而 - 14mV 的弱負(fù)電位,既能避免非特異性吸附,又能減少與紅細(xì)胞、內(nèi)皮細(xì)胞的相互作用,延長(zhǎng)體內(nèi)循環(huán)時(shí)間 —— 這正是 zeta 電位技術(shù)對(duì) “載體安全性" 的重要預(yù)判價(jià)值。
從 CD-CO NPs 的合成優(yōu)化、穩(wěn)定性驗(yàn)證,到功能實(shí)現(xiàn),納米粒度(DLS) 與zeta 電位分析始終扮演著 “眼睛" 的角色:
• 對(duì)研發(fā)端:它們幫助科研人員快速篩選最佳合成條件,避免 “盲目試錯(cuò)",加速成果落地;
• 對(duì)應(yīng)用端:它們?yōu)檩d體的 “體內(nèi)安全性"“有效性" 提供量化數(shù)據(jù),降低產(chǎn)業(yè)化風(fēng)險(xiǎn);
• 對(duì)行業(yè)端:它們推動(dòng)納米藥物從 “概念" 走向 “實(shí)用",為精準(zhǔn)醫(yī)療提供技術(shù)支撐。
DS100納米粒度及ZETA電位分析儀,由貝拓科學(xué)自主研發(fā)。它采用動(dòng)態(tài)光散射技術(shù),可精準(zhǔn)測(cè)量納米顆粒的粒徑分布與ZETA電位,并具備精確溫控功能,滿(mǎn)足不同條件下的測(cè)試需求。

未來(lái),隨著納米藥物向 “更精準(zhǔn)、更高效" 方向發(fā)展,納米粒度與 zeta 電位技術(shù)將發(fā)揮更重要的作用 —— 它們不僅是檢測(cè)工具,更是生物醫(yī)藥創(chuàng)新的 “關(guān)鍵推手"。
(注:本文數(shù)據(jù)及成果均來(lái)自《ACS Omega》2025 年發(fā)表的 “Cross-Linked Cyclodextrin-Based Nanoparticles as Drug Delivery Vehicles: Synthesis Strategy and Degradation Studies" 一文,感興趣的讀者可查閱原文深入了解。)
Wehl, L.; Muggli, K.; M?ller, K.; Engelke, H.; Bein, T. Cross-Linked Cyclodextrin-Based Nanoparticles as Drug Delivery Vehicles: Synthesis Strategy and Degradation Studies. ACS Omega 2025, *10* (12), 10352–10365.
版權(quán)所有 © 2025 廣州貝拓科學(xué)技術(shù)有限公司 備案號(hào):粵ICP備16117500號(hào) 技術(shù)支持:化工儀器網(wǎng) 管理登陸 GoogleSitemap